1.NMPA 医疗器械简介:
隶属属于中华人民共和国,国家药品监督管理局医疗器械技术评审中心,负责申请注册国产和进口医疗器械产品受理和技术评审工作;根据国家对医疗器械设备的法规规定,属于以下I,II,III类别的医疗器械产品进入中国市场前,都需要强制获得市场准入注册(NMPA)证书。
https://www.cmde.org.cn/CL0015/
2.医疗器械注册流程:
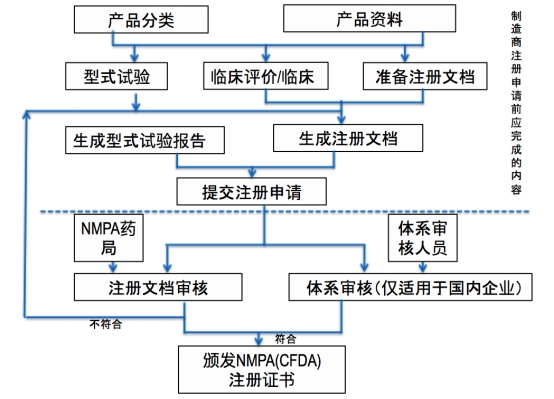
* 不同类别的医疗器械注册流程不同
3.分类界定:
为确保医疗器械产品严格按照所归属范围的注册类别,VSCB 提供前期医疗器械分类界定服务,以保证医疗器械产品按照所属类别,顺利完成医疗器械注册。
第一类风险程度低,实行常规管理可以保证其安全、有效的医疗器械。仅需备案管理。
第二类具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。需要申报注册。
第三类具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。需要申报注册。

*分类界定周期:3-4周
*如果制造商为境外企业,医疗注册必须在北京药监局完成
4.医疗器械分类界定资料:

5.本地化测试服务:
受限于国内医疗器械检测资源,企业享受了免费的同时,但是无法按照预期测试周期完成注册申报。 检测任务分配到指定的国家实验室,需要不可估量的周期来完成测试,有时甚至需要排队,等待半年以上才可以安排测试。如遇测试失败需要整改时,测试时间更是无法估算。国家实验室授权部分民间实验室可正式测试,其报告被NMPA认可。我公司已经与北京医疗器械检测实验室签署战略协议,其测试结果可以被中国医疗器械机构及国际注册机构认可,实验室服务包括:
• 根据产品特性,与国家注册机构制定适于产品的GB/YY测试标准;
• 根据GB/YT测试标准进行NMPA摸底测试;
• 摸底测试报告可用于NMPA正式测试;
• 依据Safety &EMC : IEC/EN60601-x/IEC61000-x委托测试;
• 依据EMC ; IEC/EN60601-x/IEC61000-x 正式测试;(出具TUV-SUD测试报告)
• 依据欧洲标准进行安全/生物/包装运输/灭菌验证
• GB/EN/IEC测试整改服务:
* 中国注册检验过程中,如出现测试失败,在客户明确整改需求前提下,VSCB可提供技术整改等解决方案服务。(视实际情况单独收取费用)
* 以上涉及欧盟/中国注检测试,VSCB均在北京合作实验室测试完成,可同时取得CE MDR/ FDA/NMPA(CFDA)等报告,即一份测试可以涵盖3份或多份区域认可报告。(1测3或1测多认可报告)
6.VSCB NMPA服务范围:
VSCB医疗器械专家具备行业20年以上中国和欧洲医疗器械法规,专业的注册团队,协助您提供如下服务:
• NMPA法规咨询
• NMPA 产品注检
• 制定NMPA GB/YY测试标准;
• 辅助依据GB/YY现场测试;
• 委托第三方进行临床及临床报告
• 协助临床文献比对,及准备资料
• NMPA持证代理;
• GMP 工厂监督;
• 工厂体系满足NMPA要求管理
• 提交NMPA注册申请
• NMPA注册证书发放
• NMPA证书延期
• 上市证书市场监管
• 有关中国销售市场与营销(与第三方合作)
